研究内容
Bioinspired Conjugates for Chemical Biology
天然の優れたメカニズムを謙虚に学びつつ分子設計し、
天然材料をはるかに凌駕する高機能マテリアルの開発を目指す。
生命現象およびそこから作り出される様々な生体分子は、我々に計り知れない可能性を示してくれます。当研究室ではその天然の優れたメカニズムを謙虚に学びつつ分子設計し、天然材料をはるかに超える高機能材料の開発を目指しております。具体的には核酸(DNA, RNA)やペプチドなどを縦横無尽に駆使することで、バイオテクノロジーのための新規なツール、次世代型核酸医薬、高機能ナノマテリアルの開発を行っております。また物理化学および構造生物学的なアプローチにより設計したツールやマテリアル等の機能解析も行っております。ここでは当研究室の代表的な研究を紹介します。
1. 光応答性オリゴヌクレオチド
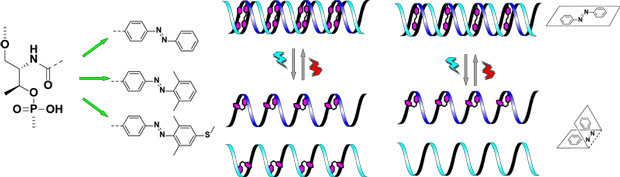
DNAはAに対してT、Gに対してCという様に相補的水素結合を通じて特定の相手のみと対(塩基対)を形成し、らせん軸に沿って積層することで二重鎖を構築するDNAはこのような単純な原理に基づいて自己組織化する性質を持ち、化学的にも安定であることから、バイオマテリアルのみならずナノマテリアルとして様々な分野での応用が期待されています。DNAをナノマテリアルに用いたナノ構造体や分子マシンは、DNAの自己組織化に基づいて設計されております。したがってDNAの二重鎖形成と解離を制御することができれば、メカニカルな動作を生み出すことが可能となります。
当研究室ではアゾベンゼンを導入した光応答性オリゴヌクレオチドを設計し、1999年に世界で初めてDNA二重鎖の形成と解離の光制御を実現しました(Angew. Chem. Int .Ed. 1999, 38, 2393-2395.)。その後配列設計の工夫やアゾベンゼンの化学修飾により、現在ではハイブリダイゼーションの完全な光制御や、細胞損傷を伴わない400nm以上の可視光のみで制御することに成功しております。この光応答性オリゴヌクレオチドを用いることで、遺伝子発現の光制御や光駆動型DNAマシンなど、DNAやRNAが関わるほぼ全ての反応やマテリアルに光応答性を付与することに成功しております。また光応答性T7プロモーターの開発にも成功し、光照射でタンパク質発現を効率よくon-offスイッチングすることにも成功しております。
数ある外部刺激の中でも、光刺激は1)反応系を汚染しない、2)分子設計により励起波長の制御が可能、3)レンズによる集光やレーザー光の利用で局所的な刺激ができる、など他の刺激には無い多くの長所を有しております。そのため我々の研究は世界中の研究者から注目されており、我々以外の研究者も我々が開発した光応答性オリゴヌクレオチドを活用しております。現在では、我々の開発した光応答性オリゴヌクレオチドを、以下の企業から購入することが出来ます(無置換型アゾベンゼンのみ)。
担当:北村 智
北海道システム・サイエンス株式会社
〒001-0932 北海道札幌市北区新川西2条1丁目2-1
TEL:011(768)5901 FAX:011(768)5951
dna@hssnet.co.jp
URL https://www.hssnet.co.jp/ ![]()
2. オリゴヌクレオチドを配列選択的に認識する高感度蛍光性プローブ
ヒト・ゲノムの全塩基配列の解読が終了したことで、一塩基変異多型(SNPs)や塩基欠失(Indel)といった、遺伝子レベルでの個人差に興味が移りつつあります。SNPsやIndelが判れば、各個人に最適な治療を行う“オーダーメード医療”の実現が期待できます。SNPsやIndelを迅速に検出するためのプローブ開発は、このような将来の医療に向けた重要な課題です。当研究室では、DNAやRNAを配列特異的に高感度で検出する新規な蛍光プローブを開発しています。
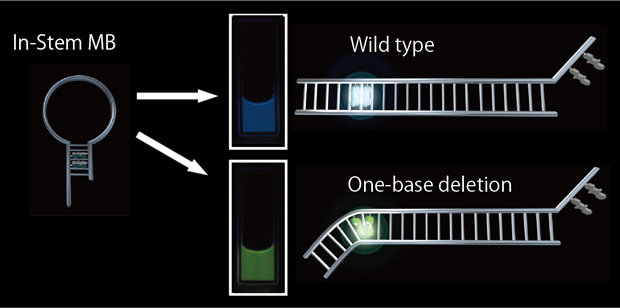
1. インステム・モレキュラービーコン
当研究室では、疑似ヌクレオチド化した蛍光色素と消光色素の対をステム領域に複数導入したインステム・モレキュラービーコン(ISNB)を提案しました。蛍光色素と消光色素を末端に導入した従来型のMBと異なり、ステム内で蛍光色素と消光色素が強固にスタックするので、ターゲット非存在下で非常に効率よく消光させることに成功しております。また配列設計により、野生型と1塩基欠失型を発光色で区別することにも成功しております。
2. リニア―プローブ
我々は、ステム構造を必要としない新たなプローブ(リニアプローブ)も提案しております。リニアプローブは、D-threoninolを足場に用いて疑似ヌクレオチド化した蛍光色素を、少なくとも天然のヌクレオチド2個挟んで複数導入した直鎖状のプローブです。柔軟な一本鎖状態では複数の蛍光色素が弱く相互作用することで消光しますが、ターゲットと二重鎖を組むと蛍光色素同士の相互作用が遮蔽されるため蛍光が増大します。したがって蛍光色素の導入数が多いほどシグナル/バックグラウンド比が大きくなります。またステム構造を持たないのでレスポンスが速いという特徴もあります。
3. 色素会合体
DNA二重鎖は決められた順序にATGC四種類の塩基が整列した超分子です。当研究室では様々な色素を共有結合を介してDNAに導入することによって、数・配向・配列の制御された色素会合体の調製に成功しております。また、異種色素による会合体の調製にも成功し、異種色素間の励起子相互作用や光環化付加反応など、これまで明らかでなかった物理現象の解明を目指しています。
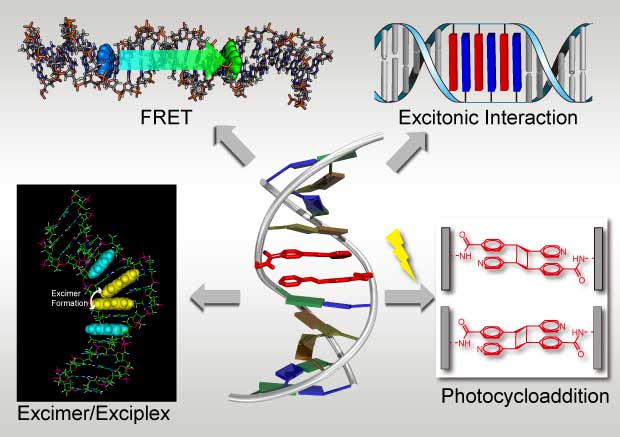
4. 人工核酸の開発
当研究室では天然核酸の主鎖構造を非環状骨格に改変したaTNA及びSNAの開発を行っております。その結果、aTNAは相補的なaTNAと極めて安定な二重鎖を形成することが分かりました。また、SNAは天然核酸と安定な二重鎖を形成することが分かっています。現在、これらの人工核酸を核酸医薬や核酸プローブとして応用すべく、研究を行っております。
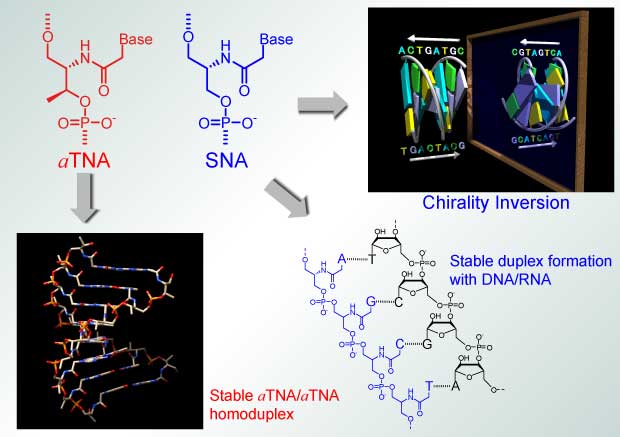
5. インスレーター
蛍光色素による核酸のラベル化は現代のバイオテクノロジーにおいて必要不可欠な技術です。しかし、核酸塩基は電子移動によって多くの蛍光色素を消光してしまうという問題点がありました。本研究室では電子移動を抑制するシクロヘキサン誘導体を人工塩基として用いることによって蛍光色素の高輝度化に成功しました。これらは蛍光ラベル化剤や核酸プローブとしての応用が期待されています。
6. 核酸医薬の開発
RNA干渉は特定の遺伝子の機能を抑制する生体システムです。siRNAなどの小分子RNAは RNA干渉を誘導することができるため、これを医薬に応用しようという試みがなされています。しかしながら、小分子RNAを医薬品として応用するためには、デリバリー、低い安定性、副作用などの問題点を解決しなければなりません。私たちは研究室で開発された人工塩基や様々な機能性分子を活用し、次世代型核酸医薬のデザインを行っております。
細胞内に取り込まれたsiRNAはRISC (RNAi-induced silencing complex)とよばれるタンパク質複合体を形成します。その後、RISC上でsiRNAの二重鎖のうちのセンス鎖が引き離され、残されたアンチセンス鎖がターゲットとなるmRNAと結合します。しかし、センス鎖が間違ってmRNAと結合してしまうと意図しない遺伝子発現の抑制が引き起こされてしまいます。これがoff-target効果の一因であると考えられています。最近、siRNAのセンス鎖の5’末端近傍に僅か1残基のインターカレーターを導入することによって、off-target効果を抑制させることに成功しました。さらに、このsiRNAの新規デザインを応用し、siRNAに蛍光物質を導入することによってRNAi機構の可視化解析にも取り組んでおります。

