論文紹介
論文要約
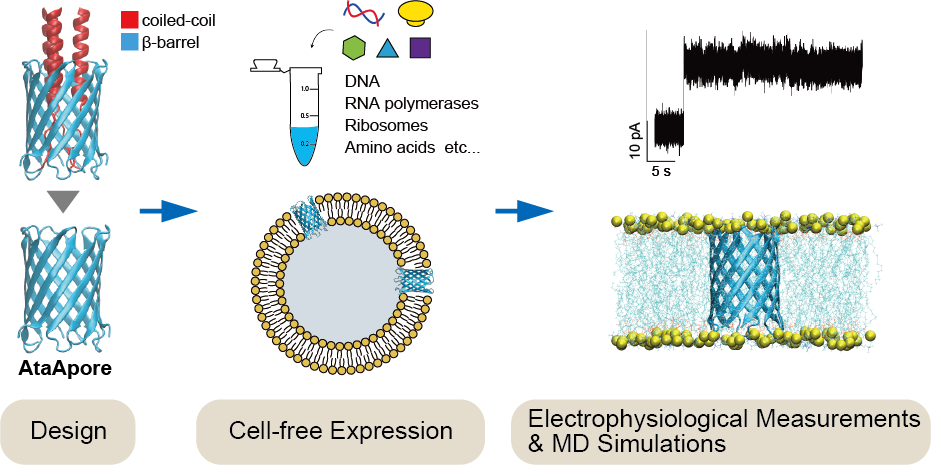
- グラム陰性細菌のタンパク質分泌機構は、細胞表層へのタンパク質提示や環境との相互作用を担う重要な生命現象であり、その膜貫通構造はナノスケールの孔 (ナノポア) として機能する可能性があることから、近年バイオセンシングなどへの応用が注目されています。三量体型オートトランスポーターアドヘシン (TAA) はtype Vc secretion systemによって細胞表層に輸送されるタンパク質群であり、そのC末端の膜貫通βバレル構造は分泌の通路として機能します。しかし、このβバレル内部は通常、輸送されるポリペプチド鎖によって占有されており、物質透過構造としての機能や応用可能性はほとんど検証されていませんでした。本研究では、Acinetobacter属細菌のTAAであるAtaAの膜貫通βバレル構造に着目し、内部を占有するコイルドコイル領域を除去することで、開いた孔構造を持つ新規ナノポア「AtaApore」を設計しました。無細胞タンパク質合成系による発現、脂質膜への再構成、電気生理測定、分子動力学シミュレーションを組み合わせることで、AtaAporeが実際に膜中で安定なナノポアとして機能し、イオンを透過させることを実証しました。さらに、ポア内部の特定のアルギニン残基が陰イオンの一時的な捕捉に関与し、イオン透過特性を制御することを明らかにしました。これにより、TAA膜貫通ドメインが分泌装置としてだけでなく、分子透過を制御可能なナノ構造として利用できる可能性が強く示唆されました。本研究は、type Vc secretion system由来のナノポアを電気生理学的に機能解析した初めての例であり、細菌分泌機構の理解を深めるとともに、新規ナノポア足場分子の創出という観点からも重要な成果です。さらに、分子センサー、人工細胞、合成生物学などへの応用展開が期待されます。なお、本研究は東京農工大学の川野研究室との共同研究です。
- 本研究では、ゼブラフィッシュの皮膚から多数の細菌株を分離し、その中から抗菌化合物を産生する細菌を見出した。この菌株はPseudomonas mosseliiと同定され、KH-ZF1と命名した。さらに、KH-ZF1が産生する抗菌化合物を分離・同定した結果、その化合物はフルビオールC (Fluviol C) であることが明らかとなった。KH-ZF1は魚類表皮に一過的に定着し、水中由来病原菌に対する抵抗性を高める方向に表皮細菌叢の組成を変化させることを示した。この防御効果は、細菌投与のタイミングおよび方法に依存していた。Fluviol Cは、病原菌の増殖を抑制する作用に加え、表皮細菌叢を再構成することによって、この防御効果に寄与している。養殖における抗生物質の過剰使用は、薬剤耐性菌の出現という深刻な問題を引き起こしている。そのため、養殖魚の感染症を予防するための代替戦略の開発が強く求められている。有望なアプローチの一つとして、魚類の皮膚に定着し、有害細菌の増殖を抑制する天然由来細菌をプロバイオティクスとして利用する方法が挙げられる。本研究は、プロバイオティクスが産生する抗菌化合物が、脊椎動物宿主の表皮細菌叢を改変し、感染リスクを低減し得ることを示した初めての研究である。本研究の知見は、有用細菌あるいはそれらが産生する生理活性化合物を用いて魚類の皮膚細菌叢を操作することが、養殖における疾病予防の有効な戦略となり得ることを示唆している。
- グラム陰性細菌の三量体型オートトランスポーターアドヘシン(TAA)はtype Vc secretion systemで細胞表層に分泌される重要な細菌付着因子です。TAAの一種であるAtaA(Acinetobacter TAA)は、ペプチドグリカンに結合するペリプラズムタンパク質TpgAと結合することが分かっていましたが、どの部位でどのように相互作用しているのかは不明でした。本研究では、リコンビナントタンパク質の相互作用解析、X線結晶構造解析、分子動力学計算、部位特異的変異体を用いた検証を組み合わせ、AtaAのC末端膜貫通ドメインがTpgAのN末端ドメインとA3B3型のヘテロ六量体として組み上がること、及びその複合体の安定化に重要な残基を明らかにしました。さらに、tpgA様遺伝子の網羅的探索と配列クラスタリングから、taaの直下にtpgAが並ぶ遺伝子カセットが重要な残基と共に多様なPseudomonadota(Proteobacteria)で広く保存されていることが分かり、TAA–TpgA複合体が種を超えて成立する可能性が強く示唆されました。これらの結果は、TAAが細胞表層提示後にペリプラズムタンパク質や、それを介してペプチドグリカンにも相互作用することを示しており、type Vc secretion systemと細胞表層構造の理解を深めるうえで重要な知見であるとともに、細菌の付着制御に向けた薬剤開発やタンパク質工学にも有用な知見です。なお、本研究はマックスプランク研究所(ドイツ)のAndrei N. Lupas教授との国際共同研究の成果です。
- 細菌は、土壌や水中、感染宿主内などの様々な環境中において、凝集やバイオフィルムといった形態をとることが多くあります。このような細菌の凝集やバイオフィルムを顕微鏡で観察し、その形態や成長過程、どのような細菌種が含まれているかを調べることは細菌の生態を研究する上で重要なアプローチの一つですが、どのような種類の細菌細胞同士が相互作用しているかを定量的に解析する手法は限られていました。本研究では、微生物凝集を観察した顕微鏡画像を1辺2μmの格子状に区切り、微小なエリア毎に含まれる細菌種の割合を数え積算することによって、2種の細菌細胞間の相互作用の割合を定量的に評価する手法(Grid Partitioning Image Analysis; GPIA)を提案しました。GPIAでは同一種類の細胞同士が凝集した(ホモ凝集)と、異なる2種の細胞同士が凝集した(ヘテロ凝集)の割合を定量的に解析することが可能です。これにより、どのような細菌細胞同士の相互作用が強いのか、あるいは弱いのかを簡便に判別することができるようになりました。また、本手法はプログラミング技術を用いず、一般に無料公開されているImageJという画像解析ソフトとExcelのみによって実行することが可能であり、解析を始めるための技術的障壁が低いのも魅力です。今回の研究成果は、細菌の凝集・バイオフィルムといった生態研究や、細菌細胞間の相互作用を触媒する表層タンパク質の機能解析などの研究に応用されることが期待されます。なお、本研究は株式会社フレンドマイクローブとの共同研究です。
- 芳香族化合物の微生物分解は環境浄化と物質変換において重要なプロセスですが、Acinetobacter sp. Tol 5におけるトルエン代謝経路は未解明でした。本研究では、Pseudomonas putidaでトルエン分解に関わることが知られているtodオペロンと高い相同性を示す遺伝子群をTol 5ゲノム中に発見しました。転写解析により、初発酵素として推定されるジオキシゲナーゼ大サブユニットであるtodC1が下流のtodFと同一オペロンとして共転写される一方で、上流の推定外膜トランスポーターfadL2は独立に転写されることを明らかにしました。遺伝子欠失株を用いた増殖試験では、todC1がトルエンおよびベンゼンを炭素源とした増殖に必須である一方で、fadL2は必須ではないことを示しました。結論として、本研究ではTol 5におけるトルエンとベンゼンの主要分解経路がTOD経路であることを明らかにしました。Tol 5の強力な付着能による迅速な固定化と組み合わせることで、環境浄化や芳香族物質を基質とするバイオものづくりの効率向上に貢献することが期待されます。なお、本研究は株式会社フレンドマイクローブとの共同研究の成果です。
-
タンパク質のリジン残基におけるメチル化修飾は、真核生物でさまざまな機能に関与する重要な翻訳後修飾として知られています。一方、原核生物ではこのような翻訳後修飾は珍しく、あまり注目されていませんでした。本研究では、トルエン分解細菌Acinetobacter sp. Tol 5をラベルフリー定量プロテオミクスで解析し、細胞表層の接着性ファイバータンパク質AtaAの多数のリジン残基がメチル化修飾を受けていることを発見しました。AtaAは3,630アミノ酸から構成されますが、その130以上のリジン残基がメチル化されていました。さらに、本研究ではTol 5の外膜タンパク質リジン残基メチル化酵素KmtAを同定し、KmtAがAtaAの多数のリジン残基のメチル化を担っていることを明らかにしました。KmtAを欠失したTol 5では、細胞の接着性が上昇し、増殖が遅くなったことから、KmtAは細胞の接着性を適度に調節するために必要であると考えられます。また、KmtAに類似する遺伝子が多種多様な病原性細菌や環境細菌にも存在することも明らかとなり、リジン残基のメチル化修飾が細菌の生理機能において従来考えられていた以上に重要であることが示されました。
本研究の成果は、アメリカ微生物学会のJournal of Bacteriology誌にてEditor's Pickに選出されました。 - 堀研究室で発見されたアシネトバクター属細菌Tol 5は、三量体型オートトランスポーターアドヘシン(TAA)タンパク質の一種であるAtaAを介して疎水性プラスチックから親水性のガラス、さらには金属まで、さまざまな材料表面に対して高い接着性を示します。本論文では、Tol 5および他のTAAを有する細菌が、細胞や生体分子が付着しにくいとされる表面に対しどの様な接着挙動を示すかを調べました。Tol 5は、表面自由エネルギーの低いポリテトラフルオロエチレン(テフロン)、親水性のポリマーブラシ、原子レベルでフラットな雲母(マイカ)表面にさえ接着しました。さらに、原子間力顕微鏡(AFM)を用いた1細胞測定により、このような難付着性表面に対する Tol 5 の強力な細胞接着力が明らかになりました。一方で、Tol 5は2-メタクリロイルオキシエチルホスホリルコリン (MPC) ポリマーに対してはほとんど接着しないことが明らかになりました。これらの結果は、生物化学工学や医学分野において注目されているAtaAを含むTAAを介した細菌接着機構の理解と制御に貢献すると考えられます。なお、本研究は東京大学の高井まどか教授、オスロ大学(ノルウェー)のDirk Linke教授、ゲーテ大学(ドイツ)のStephan Göttig教授、Volkhard A. J. Kempf教授らとの国際共同研究の成果です。
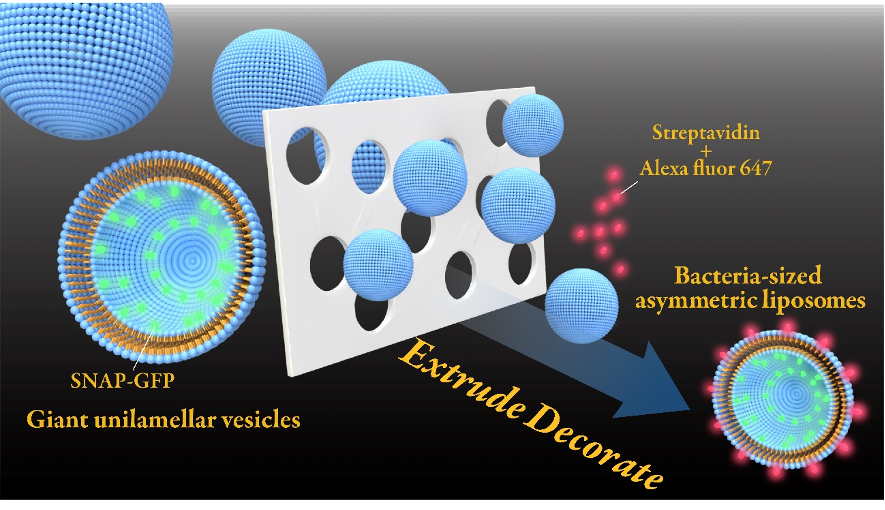
- 人工細胞の創出においては、直径10 μm以上の単一の脂質膜からなるリポソームが一般的に用いられてきました。一方で、直径約1 μmである細菌細胞のサイズや膜構造を模倣した人工細胞の作製には技術的な制約がありました。本研究では、リポソーム作製の汎用的な手法である界面通過法とエクストルーダー法を組み合わせることで、脂質二重層の内外で異なるタンパク質を局在させた非対称リポソームを簡便に作製する手法を開発しました。本研究成果は、人工細菌細胞創出に向けた一歩であるとともに、細菌の膜構造やそこに存在するタンパク質の機能解析に貢献することが期待できます。なお、本研究は東京工業大学の松浦研究室、東北大学の田中研究室との共同研究です。
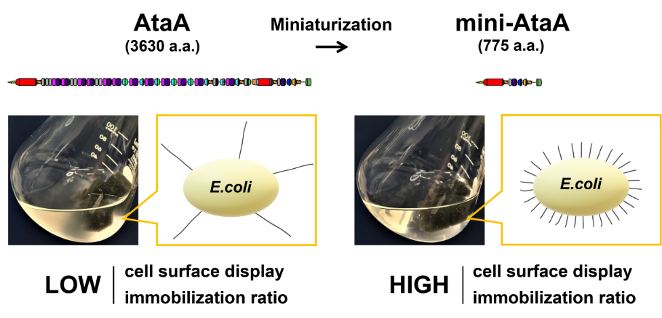
- 堀研究室では、独自の材料であるナノファイバータンパク質AtaAを細菌細胞に生やすことで、簡便で強力、しかも可逆的な微生物固定化法を開発してきました。しかし、AtaAは3630アミノ酸残基から構成されるポリペプチド鎖がホモ三量体を形成する巨大なタンパク質であるため、限られた細菌にしか生やすことはできませんでした。本研究では、AtaAの接着部位を特定し、機能を維持したまま775アミノ酸残基まで小型化することに成功しました。これにより、増殖速度や他の酵素活性を低下させることなく小型化AtaAを産業上有用な細菌である大腸菌に生やすことに成功し、固定化微生物反応に供すことができるようになりました。本研究成果は、環境負荷の低いバイオプロセスによるものづくりを加速し、カーボンニュートラルの実現に貢献することが期待されます。なお、本研究はマックスプランク研究所(ドイツ)のAndrei N. Lupas教授、オスロ大学(ノルウェー)のDirk Linke教授との国際共同研究です。
- 堀研究室で発見されたアシネトバクター属細菌Tol 5はナノファイバータンパク質AtaAを介して様々な材料表面に対し付着するユニークな特性を示します。しかしTol 5は自己凝集性も示すため、表面に付着した菌体数を計測する従来の付着試験法ではTol 5と材料表面の純粋な相互作用を評価することはできませんでした。本研究では、微細な探針で試料表面を走査することでナノメートルサイズの凹凸やピコニュートンレベルの力を計測できる原子間力顕微鏡(AFM)を用いることで、Tol 5と材料表面間に働く付着力を1細胞レベルで液中測定しました。その結果、Tol 5は他の細菌と比べ顕著に強い接着力を示すことが明らかになりました。さらに、Tol 5の付着を低下させることが知られていた低イオン強度環境とカザミノ酸溶液は、それぞれ異なるメカニズムで作用していることが明らかになりました。本研究の成果としてAtaAを介したTol 5の付着に関する理解が深まることで、AtaAを用いた細菌固定化技術のさらなる発展が期待されます。
- 堀研究室で発見した高付着性細菌アシネトバクター属Tol 5の完全ゲノム配列を決定しました。Tol 5のゲノムには巨大なリピート配列があるため、短いリードしか解析できない次世代シーケンサー(NGS)では完全長のゲノムを決定できていませんでした。本研究では長いリードを解析可能なナノポアシーケンサーMinIONと、ラボトップモデルNGSのiSeq 100を用いることで精度の高い完全長ゲノムを決定することができました。これまでゲノム配列の決定は外部委託解析によって行われることが一般的でしたが、MinIONとiSeq 100を保有する堀研究室では数日中にゲノム決定することができます。決定したゲノム配列により、Tol 5の研究がより一層前進することが期待できます。
- 気相微生物反応は堀研究室で開発した革新的なバイオプロセスです。リアクターから液相を取り除くことで、気体分子の拡散速度を向上させ、微生物反応のパフォーマンスを劇的に向上させることができます。このような反応条件において微生物は、従来の微生物反応系(液相のある反応系)とは異なる代謝動態になっていることが予想されます。本研究では、代表的なメタン細菌であるMethylococcus capsulatus (Bath)を用いて気相微生物反応時における代謝動態の変化をメタボローム解析によって明らかにしました。気相反応では液相反応と大きく異なる代謝状態になっており、さらにそれは物質生産に適した代謝状態であることが示唆されました。本研究の成果は気相微生物反応のさらなる効率化や、新たな物質生産のためのヒントをもたらしました。なお、本研究は九州大学の馬場研究室との共同研究です。
- 遺伝子組換え微生物(GEM)は、生態系を乱すリスクがあることから環境中に流出することを厳しく制限されています。そのため、遺伝子改変技術の向上によって便利なGEMがたくさん開発されているにも関わらず、環境浄化にはGEMを利用することができていません。「生物学的封じ込め」とは、GEMを特定の環境でしか生きられないようにして生態系に影響を与えないようにする技術です。私達は、「汚染物質を分解するが、その汚染物質が存在する環境でしか生きられないGEM」を作ることができれば、GEMを環境保全に活用できると考えました(GEMは汚染物質を分解したあとは死滅する)。本研究では、トルエンを分解した後は増殖しないGEMの開発に取り組みました。開発したGEMはトルエンを分解した後の増殖は著しく制限されましたが、完全に抑えることはできませんでした。この原因を探るために、ナノポアシーケンサーMinIONを用いて遺伝子解析を行い、改善点を発見し提案しました。得られた成果は環境保全に向けた生物学的封じ込め技術の開発に重要です。
J. Sasahara, S. Yoshimoto, Z. Peng, T. Hwang, I. Kobayashi, R. Kawano, K. Hori
Construction and characterization of a nanopore derived from the transmembrane domain of a trimeric autotransporter adhesin
Front. Bioeng. Biotechnol. 14, 1764864 (2026).
H. Nakatani, N. Suetake, K. Hori
Antimicrobial-producing bacteria from fish epidermal mucus alter the fish epidermal bacterial flora and host resistance to infection
Appl. Environ. Microbiol. 91, e01450-25 (2025).
S. Yoshimoto, J. Sasahara, A. Suzuki, J. Kanie, K. Koiwai, A. N. Lupas, K. Hori
Insights into the complex formation of a trimeric autotransporter adhesin with a peptidoglycan-binding periplasmic protein
Cell Surf. 14, 100155 (2025).

Y. Ohara, S. Yoshimoto, K. Hori
Grid partitioning image analysis of highly aggregative bacterium Acinetobacter sp. Tol 5
Front. Microbiol. 16, 1637462 (2025).

S. Yoshimoto, M. Hattori, S. Inoue, S. Mori, Y. Ohara and K. Hori
Identification of toluene degradation genes in Acinetobacter sp. Tol 5
J. Biosci. Bioeng. 140, 284-289 (2025).
S. Inoue, S. Yoshimoto, K. Hori
A new target of multiple lysine methylation in bacteria
J. Bacteriol. 207, e00325-24 (2025).
S. Yoshimoto, S. Ishii, A. Kawashiri, T. Matsushita, D. Linke, S. Göttig, VAJ. Kempf, M. Takai and K. Hori
Adhesion preference of the sticky bacterium Acinetobacter sp. Tol 5
Front. Bioeng. Biotechnol. 12, 1342418 (2024).
K. Noba, S. Yoshimoto, Y. Tanaka, T. Yokoyama, T. Matsuura, and K. Hori
Simple Method for the Creation of a Bacteria-Sized Unilamellar Liposome with Different Proteins Localized to the Respective Sides of the Membrane
ACS Synth. Biol. 12,1437-1446 (2023).
S. Yoshimoto, S. Aoki, Y. Ohara, M. Ishikawa, A. Suzuki, D. Linke, A. Lupas, and K. Hori
Identification of the adhesive domain of AtaA from Acinetobacter sp. Tol 5 and its application in immobilizing Escherichia coli
Front. Bioeng. Biotechnol. 10, 1095057 (2023).
S. Ishii, S. Yoshimoto and K. Hori
Single-cell adhesion force mapping of a highly sticky bacterium in liquid
J. Colloid Interface Sci. 606, 628-634 (2022).

M. Ishikawa and K. Hori
Complete Genome Sequence of the Highly Adhesive Bacterium Acinetobacter sp. Strain Tol 5
Microbiol. Resour. Announc. 10, e00567-21 (2021).
Y.-Y. Chen, Y. Soma, M. Ishikawa, M. Takahashi, Y. Izumi, T. Bamba and K. Hori
Metabolic alteration of Methylococcus capsulatus str. Bath during a microbial gas-phase reaction
Biores. Technol. 330, 125002 (2021).
M. Ishikawa, T. Kojima, and K. Hori
Development of a Biocontained Toluene-Degrading Bacterium for Environmental Protection
Microbiol. Spectr. 9, e00259-21 (2021).
